鷹揚郷腎研究所
鷹揚郷腎研究所 Oyokyo Kidney Research Institute
鷹揚郷腎研究所には、腎疾患研究部門と癌免疫細胞生物学研究部門があり、総合的に腎疾患の臨床および基礎研究を行っています。
腎疾患研究部門にはさらに、「代謝・生化学」「移植免疫・組織化学」「ラジオアイソトープ」「臨床医学」「病態画像」の各研究部が あり、山谷金光顧問、弘前病院長、青森病院長を中心に各部署のスタッフが協力し合い、腎疾患治療の質の向上を目的として、腎不全患者さんの病態の解明 に向けて研究しています。
癌免疫細胞生物学研究部は、坪井滋部長を中心に、腎がんをはじめとする泌尿器科的がんについて研究しています。
癌免疫細胞生物学研究部
研究概要
われわれの体を蝕む「がん」のうち、胃、肺、大腸などの臓器の上皮組織から生じたものを特に「癌」と表記します。癌患者の死亡の直接的原因の多くは、他臓器への転移、再発であることがわかっています。したがって、転移を抑えることができれば、多くの癌患者の命を救うことができます。癌の転移を抑える薬剤、および、治療法を開発するためには、この癌の転移の過程をより深く理解する必要があります。このための努力が、多くの研究者によって続けられています。
私たちの研究グループでは、癌の転移の過程をより深く理解するために、細胞や実験動物を用いて、以下の2つの基礎的な研究を行っています。
- 腫瘍免疫逃避機構の研究
- 癌細胞の浸潤過程の研究
本研究所は泌尿器関連疾患の基礎研究を主たるミッションとしています。そこで、私たちの研究グループでは、泌尿器科系癌(前立腺癌、膀胱癌、腎癌、精巣腫瘍)に焦点を絞り、弘前大学大学院医学研究科泌尿器科学講座と共同で研究を進めています。研究成果は、学会発表、および、論文を通じて世界に発信しています。私たちのグループは、基礎研究を通して、これらの癌の転移の過程に関する理解を深め、将来、臨床成績の向上に繋がるような成果を目指しています。
癌免疫・細胞生物学研究部
部長 坪井 滋
研究テーマ紹介
- 腫瘍免疫逃避機構の研究
私たちの体内に生じた癌細胞は、通常は免疫細胞によって攻撃されて排除されます。これを腫瘍免疫と呼びます。免疫細胞は、癌細胞を「排除すべき異種細胞」と認識し、攻撃して排除します。しかしながら、癌細胞の集団の中で、免疫細胞による攻撃から逃避する能力を獲得した癌細胞が生じることがあります。このような癌細胞は体内で長く生存できるようになり、他の臓器に転移し、そこで盛んに増殖し、私たちを死に至らしめます。私たちの研究グループでは、この腫瘍免疫逃避の機構を明らかにするための研究を行っています。
癌細胞を攻撃する免疫細胞は、主として以下の2種類です。
ナチュラル・キラー細胞(NK 細胞)
NK細胞は、血液中に存在し、常に体中を循環してパトロールしています。癌細胞を見つけると、その癌細胞を攻撃して排除してくれます。このNK細胞は、主として癌が最初に生じた臓器内(原発部位)にあるときや、癌細胞が原発部位を離れて血管内に入り、体中を循環しているときに働きます。
(長所)血中に常に多数存在し、できたばかりの小さな癌をすぐに排除してくれる。
(短所)癌がある程度大きくなると癌細胞を排除しきれなくなる。
細胞傷害性Tリンパ球(CTL)
CTLは、体内に生じた癌の特徴を認識し、その特徴を持つ癌細胞だけを見つけ出して攻撃します。主として癌が大きくなったときや、転移した癌に対して働きます。
(長所)体内にできた癌細胞だけを認識して排除します。ある程度大きくなった癌や転移した癌にも有効。
(短所)体内にほんの僅かしか存在せず、癌を攻撃するために大量に増えるまで時間がかかる。
(1)特殊な癌細胞がNK細胞による免疫から逃れる機構
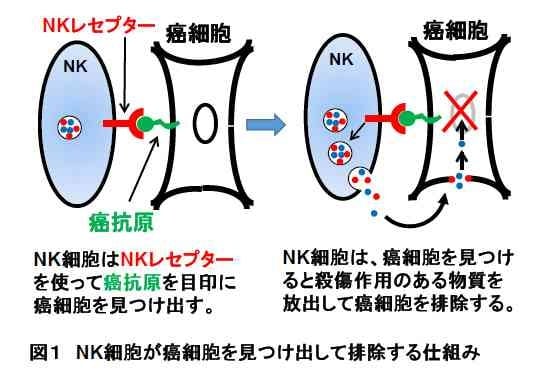
NK細胞による癌細胞排除の仕組み-私たちを癌から守ってくれるNK細胞は、どのような仕組みで癌を排除しているのでしょうか?
NK細胞は、体内で細胞に出会うと、まず、「正常な自分の細胞」か「癌細胞」かの識別を行います。そして、識別された「癌細胞」のみを攻撃し、傷害し、排除することができます。正常な細胞が癌細胞になると、癌細胞は、正常な細胞には存在しない癌抗原と呼ばれるタンパク質を表面に持つようになります。この癌抗原は、癌細胞の目印となります。一方、NK細胞の表面には、この癌抗原を認識できるNKレセプターというタンパク質が存在します。NK細胞は、このNKレセプターを使って癌抗原を持つ細胞(つまり癌細胞)を見つけ出し、癌細胞を攻撃して排除します(図1)。
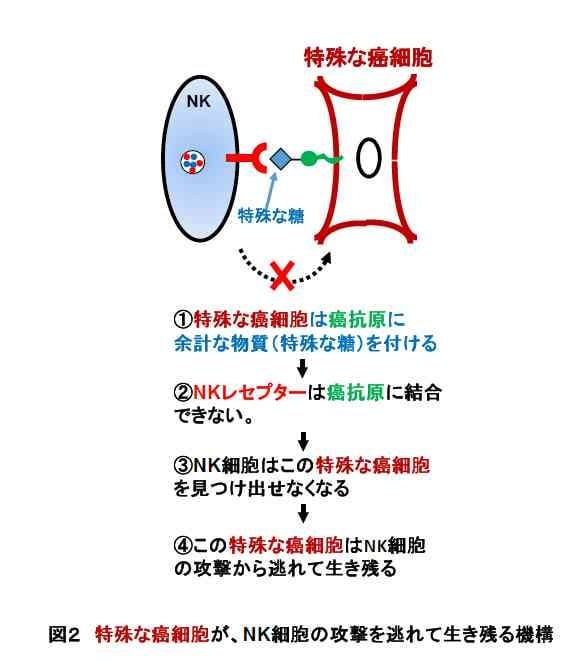
特殊な癌細胞がNK細胞による攻撃から逃れる機構-癌に対するNK細胞の免疫反応をNK腫瘍免疫と呼びます。私たちの研究グループは、ある特徴を持つ特殊な癌細胞が、このNK腫瘍免疫から逃避していることに気が付きました。
その特殊な癌細胞の特徴とは、癌抗原に余計な物質が付いていることでした。この余計な物資は、コア2O-グリカンと呼ばれる特殊なタイプの糖であることがわかりました。その後の私たちのグループの研究によって、このような特殊な癌細胞は、次のような機構でNK細胞による攻撃から逃れていることが明らかになりました。
- コア2O-グリカンと呼ばれる特殊な糖を持つ癌細胞は、この糖で自分の癌抗原を覆い隠している。
- この糖のため、NK活性化レセプターは癌抗原と結合しにくくなる。
- このため、NK細胞は癌細胞を認識することができず、攻撃・排除することができなくなる。(図2を参照)
- 結果として、この癌細胞はNK細胞の攻撃から逃れて生き残る。
「癌細胞がNK腫瘍免疫からどのような機構で逃避しているのか?」この腫瘍免疫上の最も重要な問題への取り組みの中で、私たちの研究グループは、一つ大きな成果を挙げることができました。私たちの研究により、癌細胞は、細胞表面タンパク質の糖の構造を改変し、NK細胞による認識を逃れるという戦略を用いていることが明らかにされました。本研究は、欧州の科学誌に論文発表され(Tsuboi, Sutoh et al., 2011)、また、一般メディアにも取り上げられました(平成21年7月2日 東奥日報、陸奥新報)。
この特殊な糖を使ってNK細胞の攻撃から逃れる機構について、私たちは、さらにいくつかの重要なことを明らかにし、論文発表を行いました(Okamoto, Yoneyama et al., 2013, Suzuki, Sutoh et al., 2012)。
(2)特殊な癌細胞がCTLによる免疫から逃れる機構
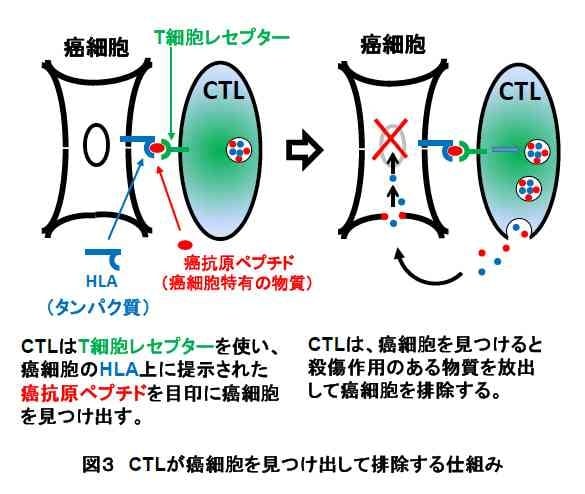
私たちの体は、もう一つ重要な腫瘍免疫システムを持っています。細胞傷害性Tリンパ球 (CTL) によるCTL腫瘍免疫です。これは獲得免疫システムの一つで、ある程度大きくなった癌や、転移した癌を攻撃するために主として働きます。私たちの体内に癌ができると、この癌だけを認識して攻撃する特別なリンパ球であるCTLが体内に出現してきます。このCTLの働きで、私たちの体内にできた癌は、そう簡単に大きな腫瘍にはならないのです。CTLが癌細胞を見つけ出して攻撃するしくみは以下の通りであることがわかっています。
CTLによる癌細胞排除の仕組み-われわれの体内に癌細胞が生じると、わわれわれの持つ免疫反応を作動させ、この癌細胞だけの特徴を認識して攻撃できるCTLを作り出します。この癌細胞は、癌細胞特有のペプチドと呼ばれる小さい物質を、癌細胞表面のHLAと呼ばれるタンパク質の上に結合して提示しています。この癌細胞だけを攻撃できるCTLは、このペプチドを目印にしています。つまり、癌細胞表面のHLAは、癌細胞の特徴(ペプチド)を、CTLの目印になるように、癌細胞の表面に提示しており、CTLはこれを目印に癌細胞を見つけ出して攻撃し、排除します(図3)。
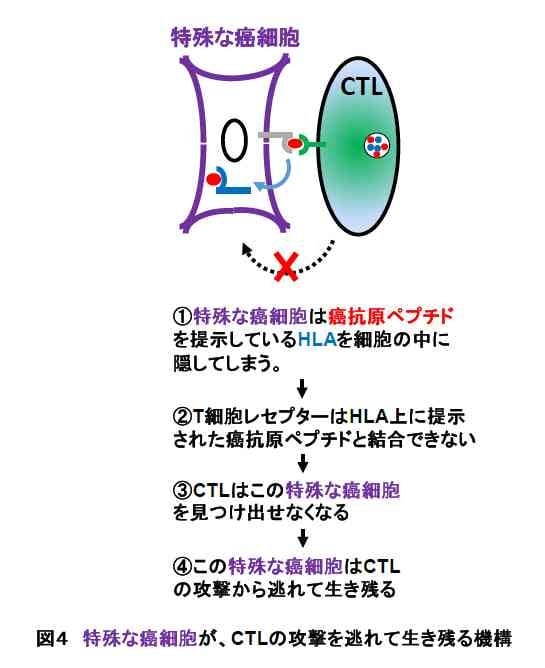
特殊な癌細胞がCTLによる攻撃から逃れる機構-ところが、私たちは、ある特殊な癌細胞(NK細胞の攻撃から逃れる癌細胞とは別のタイプの細胞)が、このCTLの攻撃から逃れていることを見出しました。この特殊な癌細胞は、CTLの目印となるペプチドを提示するためのHLAが、細胞表面にごく僅かしか存在していなかったのです。HLAが少なければ、CTLの目印となるペプチドを僅かしか提示できず、CTLがこの癌細胞を見つけにくくなり、結局、この癌細胞はCTLの攻撃から逃れてしまいます。
私たちのグループがさらに研究を進めた結果、HLAが細胞表面にたくさん存在するためには、HLAには、コア2O-グリカンと呼ばれる特殊な糖が付いていなければならないということがわかりました。さらに、研究を進めた結果、最近になって、CTLの攻撃から逃れる特殊な癌細胞では、このHLAを細胞表面にたくさん存在させるための糖、コア2O-グリカンがごくわずかしか付いていないことが明らかになりました。
私たちのグループの研究によって、この特殊な糖が極めて少ない癌細胞は、次のような機構でCTLによる攻撃から逃れていることがわかりました(図4)。
- コア2O-グリカンと呼ばれる特殊な糖がわずかしか付いていないHLAは、この特殊な癌細胞の表面に安定して存在することができない。
- この特殊な癌細胞には、HLAが細胞表面にわずかしか存在しないため、CTLの目印となるペプチドもわずかしか提示できない。
- このため、CTLは癌細胞を見つけることができず、攻撃して排除することができなくなる。(図4を参照)
- 結果として、この癌細胞は、CTLの攻撃を逃れて体内で生き残る。
この研究は、学会誌に論文発表されました(Sutoh Yoneyama, Tobisawa et al., 2017)。
癌細胞が、どのようにしてCTL腫瘍免疫から逃避しているのか、その戦略を理解することは、CTL腫瘍免疫システムを利用した療法の改良、開発に繋がることが期待されます。
現在、私たちは、そのCTL腫瘍免疫から逃避する癌側の戦略をさらに詳しく明らかにするために研究を進めています。
- 癌細胞浸潤過程の研究
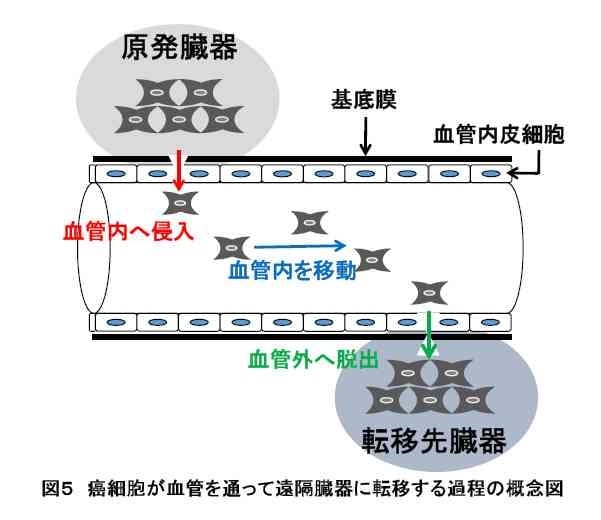
癌が最初にできた臓器(原発臓器)から離れた臓器へ転移する経路には、血行性転移、リンパ行性転移、播種性転移の3つが存在することが知られています。いずれの経路においても、癌細胞は、まず原発部位から周りの組織・臓器に広がっていく過程が必要です。この過程を浸潤と呼びます。癌細胞が浸潤しなければ、転移も起きず、外科的に取り去ってしまうことで癌を治すことが可能です。したがって、癌を治すためには、癌細胞の浸潤を食い止めることが必要であると考えられます。ところが、癌細胞がどのようなしくみによって浸潤するのか、まだ完全には解明されていません。私たちのグループは、この癌の浸潤を食い止めるために、浸潤のしくみを明らかにすることを目指し、膀胱癌の肺転移に焦点を絞って研究を行っています。
膀胱癌の血行性肺転移
膀胱癌は、膀胱で増殖した後、血管に侵入し、血流を通じて、肺や肝臓などの遠隔臓器に転移します。この転移が膀胱癌患者の予後を著しく悪化させています。膀胱癌が肺に転移する場合、以下の2つの浸潤過程が存在します(図5)。
増殖した膀胱癌細胞が膀胱の筋層を破り、血管内に侵入する過程、および、血管内の膀胱癌細胞が転移先の臓器で血管から脱出し、その臓器内に侵入する過程です。
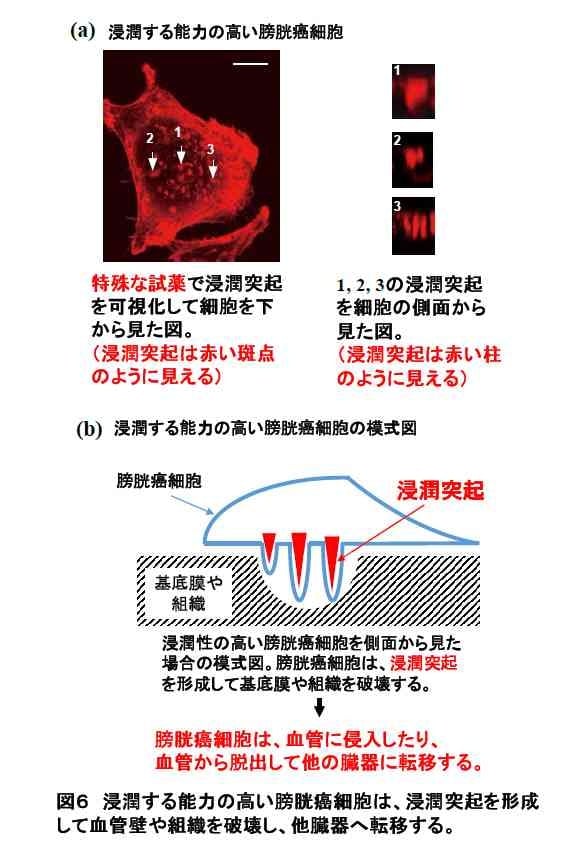
癌細胞が浸潤するためには、基底膜や細胞外基質を分解して、周辺組織へ移動して広がっていくことが必要です。これには、浸潤突起(Invadopodia)と呼ばれる突起状の細胞膜構造の形成が必要であることがわかっています。しかしながら、この浸潤突起がどのようなしくみで形成されるのかは、まだ完全には理解されていません(図6(a),(b))。私たちのグループはこの点に着目し、癌細胞の浸潤突起形成機構に焦点を絞って研究を行っています。
膀胱癌細胞の浸潤過程についての私たちの研究成果
私たちの研究グループは、近年、浸潤突起の役割とその形成機構について以下の研究成果を挙げました。
- 浸潤突起は、膀胱癌細胞が膀胱から筋層に浸潤する過程、および、血管から脱出して転移先の臓器に侵入する過程の両方で必須の役割を果たす(Imanishi, Yoneyama et al., 2014, Tokui, Yoneyama et al., 2014)。
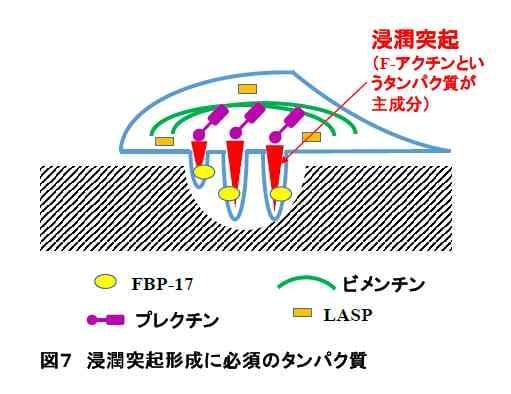
- 浸潤突起形成には、種々のタンパク質が働くことが知られていましたが、私たちは、FBP-17(Yamamoto, Sutoh et al., 2011)、ビメンチン、プレクチン(Sutoh Yoneyama, Hatakeyama et al., 2014)、LASP-1(Sato, Sutoh Yoneyama et al., 2017)の4つのタンパク質が働くことを新たに明らかにしました。FBP-17は、突起形成のための細胞膜の変形を行い、ビメンチン、プレクチン、LASP-1は、浸潤突起のアクチン骨格の安定化を行うことがわかりました(図7)。
今後は、浸潤突起形成に関わる因子の研究をさらに深めていき、浸潤転移形成機構の全容解明に迫りたいと考えています。浸潤突起形成機構の解明は、癌細胞の浸潤を食い止める手段、および、転移を抑制する薬剤の開発に繋がることが期待されます。
引用文献
Imanishi K, Yoneyama MS, Hatakeyama S, Yamamoto H, Koie T, Saitoh H, Yamaya K, Funyu T, Nakamura T, Ohyama C, Tsuboi S (2014) Invadopodia are essential in transurothelial invasion during the muscle invasion of bladder cancer cells. Mol Med Rep 9: 2159-65
Okamoto T, Yoneyama MS, Hatakeyama S, Mori K, Yamamoto H, Koie T, Saitoh H, Yamaya K, Funyu T, Fukuda M, Ohyama C, Tsuboi S (2013) Core2 O-glycan-expressing prostate cancer cells are resistant to NK cell immunity. Mol Med Rep 7: 359-64
Sato M, Sutoh Yoneyama M, Hatakeyama S, Funyu T, Suzuki T, Ohyama C, Tsuboi S (2017) The role of LIM and SH3 protein-1 in bladder cancer metastasis. Oncology Letters in press
Sutoh Yoneyama M, Hatakeyama S, Habuchi T, Inoue T, Nakamura T, Funyu T, Wiche G, Ohyama C, Tsuboi S (2014) Vimentin intermediate filament and plectin provide a scaffold for invadopodia, facilitating cancer cell invasion and extravasation for metastasis. European journal of cell biology 93: 157-69
Sutoh Yoneyama M, Tobisawa Y, Hatakeyama S, Sato M, Tone K, Tatara Y, Kakizaki I, Funyu T, Fukuda M, Hoshi S, Ohyama C, Tsuboi S (2017) A mechanism for evasion of CTL immunity by altered O-glycosylation of HLA class I. J Biochem 161: 479-492
Suzuki Y, Sutoh M, Hatakeyama S, Mori K, Yamamoto H, Koie T, Saitoh H, Yamaya K, Funyu T, Habuchi T, Arai Y, Fukuda M, Ohyama C, Tsuboi S (2012) MUC1 carrying core 2 O-glycans functions as a molecular shield against NK cell attack, promoting bladder tumor metastasis. Int J Oncol 40: 1831-8
Tokui N, Yoneyama MS, Hatakeyama S, Yamamoto H, Koie T, Saitoh H, Yamaya K, Funyu T, Nakamura T, Ohyama C, Tsuboi S (2014) Extravasation during bladder cancer metastasis requires cortactinmediated invadopodia formation. Mol Med Rep 9: 1142-6
Tsuboi S, Sutoh M, Hatakeyama S, Hiraoka N, Habuchi T, Horikawa Y, Hashimoto Y, Yoneyama T, Mori K, Koie T, Nakamura T, Saitoh H, Yamaya K, Funyu T, Fukuda M, Ohyama C (2011) A novel strategy for evasion of NK cell immunity by tumours expressing core2 O-glycans. EMBO J 30: 3173-85
Yamamoto H, Sutoh M, Hatakeyama S, Hashimoto Y, Yoneyama T, Koie T, Saitoh H, Yamaya K, Funyu T, Nakamura T, Ohyama C, Tsuboi S (2011) Requirement for FBP17 in invadopodia formation by invasive bladder tumor cells. J Urol 185: 1930-8
発表論文(2009年以降)
原著論文(欧文)
*Correspondence author
- Sato, M., Sutoh Yoneyama, M., Hatakeyama, S., Funyu, T., Suzuki, T., Ohyama C. and *Tsuboi, S. The roles of LIM and SH3 protein-1 in bladder cancer metastasis. Oncology Letters 2017 in press.
- Sutoh Yoneyama, M., Tobisawa, Y., Hatakeyama, S., Sato, M., Tone, K., Tatara, Y., Kakizaki, I., Funyu, T., Fukuda, M., Hoshi, S., Ohyama, C. and *Tsuboi, S. A mechanism for evasion of CTL immunity by altered O-glycosylation of HLA class I. Journal of Biochemistry 161(6): 479-492, 2017
- Sutoh Yoneyama, M., Hatakeyama, S., Habuchi, T., Inoue, T., Nakamura, T., Funyu, T., Wiche, G., Ohyama, C. and *Tsuboi, S. Vimentin intermediate filament and plectin provide a scaffold for invadopodia, facilitating cancer cell invasion and extravasation for metastasis. European Journal of Cell Biology 93: 157-169, 2014
- Imanishi, K., Sutoh Yoneyama, M., Hatakeyama, S., Yamamoto, H., Koie, T., Saitoh, H., Yamaya, K., Funyu, T., Nakamura, T., Ohyama, C. and *Tsuboi, S. Invadopodia play an essential role in transendothelial invasion during muscle invasion of bladder cancer cells. Molecular Medicine Reports 9: 2159-2165, 2014
- Tokui, N., Sutoh Yoneyama, M., Hatakeyama, S., Yamamoto, H., Koie, T., Saitoh, H., Yamaya, K., Funyu, T., Nakamura, T., Ohyama, C. and *Tsuboi, S. Extravasation during bladder cancer metastasis requires cortactin-mediated invadopodia formation. Molecular Medicine Reports 9: 1142-1146, 2014.
- Sugiyama, N., Sutoh Yoneyama, M., Hatakeyama, S., Yamamoto, H., Okamoto, A., Koie, T., Saitoh, H., Yamaya, K., Funyu, T., Nakamura, T., Ohyama, C. and *Tsuboi, S. In vivo selection of high-metastatic subline of bladder cancer cell and its characterization. Oncology Research 20: 289-295, 2013
- Okamoto, T., Sutoh Yoneyama, M., Hatakeyama, S., Mori, K., Yamamoto, H., Koie, T., Saitoh, H., Yamaya, K., Funyu, T., Fukuda, M., Ohyama, C. and *Tsuboi, S. Core2 O-glycan-expressing prostate cancer cells are resistant to NK cell immunity. Molecular Medicine Reports 7: 359-364, 2013 .
- Suzuki, Y., Sutoh, M., Hatakeyama, S., Mori, K., Yamamoto, H., Koie, T., Saitoh, H., Yamaya, K., Funyu, T., Habuchi, T., Arai, Y., Fukuda, M., Ohyama, C. and *Tsuboi, S. MUC1 carrying core 2 O-glycans functions as a molecular shield against NK cell attack, promoting bladder tumor metastasis.International Journal of Oncology 40: 1831-1838, 2012.
- *Tsuboi, S., Sutoh, M., Hatakeyama, S., Hiraoka, N., Habuchi, T., Horikawa, Y., Hashimoto, Y.,Yoneyama, T., Mori, K., Koie, T., Nakamura, T., Saitoh, H., Yamaya, K., Funyu, T., Fukuda, M. and Ohyama, C. A novel strategy for evasion of NK cell immunity by tumours expressing core2 O-glycans. EMBO Journal 30: 3173-3185, 2011
- Yamamoto, H., Sutoh, M., Hatakeyama, S., Hashimoto, Y.,Yoneyama, T., Koie, T., Saitoh, H., Yamaya, K., Funyu, T., Nakamura, T., Ohyama, C. and *Tsuboi, S. Requirement for FBP17 in invadopodia formation by invasive bladder tumor cells. Journal of Urology 185: 1930-1938, 2011.
- Sutoh, M., Hashimoto, Y.,Yoneyama, T., Yamamoto, H., Hatakeyama, S., Koie, T., Okamoto, A., Yamaya, K., Saitoh, H., Funyu, T., Nakamura, T., Sato, T., Ohyama, C. and *Tsuboi, S. Invadopodia formation by bladder tumor cells. Oncology Research 19: 85-92, 2010.
- *Tsuboi, S., Takada, H., Hara, T., Mochizuki, N., Funyu, T., Saitoh, H., Terayama, Y., Yamaya, K., Ohyama, C., Nonoyama, S. and Ochs, H. D. FBP17 mediates a common molecular step in the formation of podosomes and phagocytic cups in macrophages. Journal of Biological Chemistry 284: 8548-8556, 2009.
総説
*Correspondence author
- *坪井 滋、 畠山真吾、 大山 力 O-グリカンによる膀胱癌の新規免疫逃避機構 病理と臨床 31(8): 868-874, 2013 (依頼執筆のため査読無し)
- Tsuboi, S. Immunosuppressive functions of core2 O-glycans against NK immunity. Trends in Glycoscience and Glycotechnology 25(143): 117-123, 2013 (査読有り)
- *Tsuboi, S. Tumor defense systems using O-glycans. Biological and Pharmaceutical Bulletin 35(10): 1633-1636, 2012. (査読有り)
- *Tsuboi, S., Hatakeyama, S., Ohyama, C. and Fukuda, M. Two opposing roles of O-glycans in tumor metastasis. Trends in Molecular Medicine 18: 224-232, 2012. (査読有り)
その他(書籍)
- Shigeru Tsuboi (分担執筆)
(論文名)Roles of Glycans in Immune Evasion from NK Immunity
(書名)Sugar Chains
In: Tadashi Suzuki, Kazuaki Ohtsubo, Naoyuki Taniguchi, editors.
Springer 2015. p.177-188
ISBN 978-4-431-55381-6.
- Shigeru Tsuboi (分担執筆)
(論文名)Glycans against NK tumor immunity
(書名)Glycoscience : Biology and Medicine
In: Naoyuki Taniguchi, Tamao Endo, Gerald Hart, Peter Seeberger, Chi-Huey Wong, editors.
Springer 2015. p.1403-1410
ISBN 978-4-431-54842-3
- Shigeru Tsuboi (分担執筆)
(論文名)Beta-1,3-galactosyl-O-glycosyl-glycoprotein beta-1,6-N-acetylglucosaminyltrasnsferase 1 (GCNT1) (C2GnT-L) and
Beta-1,3-galactosyl-O-glycosyl-glycoprotein beta-1,6-N-acetylglucosaminyltrasnsferase 3 (GCNT4) (C2GnT-T)
(書名)Handbook of Glycosyltransferases and Related Genes
In: Naoyuki Taniguchi, Koichi Honke, Minoru Fukuda, Hisashi Narimatsu,
Yoshiki Yamaguchi and Takashi Angata, editors.
Springer; 2014. p.355-366
ISBN 978-4-431-54239-1 (Print)